Naukowcy z Polski i Włoch określili strukturę białka odpowiadającego za odczuwanie zimna. Białko to odgrywa rolę m.in. w kojeniu bólu, dlatego wyniki mogą w przyszłości pomóc w opracowaniu nowych terapii medycznych, np. związanych z bólami neuropatycznymi czy zespołem jelita drażliwego.
Trwające dwa lata badania, realizowane z wykorzystaniem kriomikroskopii elektronowej, były częściowo wspierane algorytmem sztucznej inteligencji AlphaFold, który został użyty do wymodelowania wybranych fragmentów białka. Wyniki badania opublikowane zostały w czasopiśmie Communications Biology, a o badaniach poinformowali przedstawiciele warszawskiego Międzynarodowego Instytutu Biologii Molekularnej i Komórkowej w przesłanym PAP komunikacie.
Za percepcję temperatury i innych bodźców zewnętrznych odpowiadają receptory znajdujące się m.in. w zakończeniach nerwowych w naszej skórze. Wśród nich prym wiodą białka z rodziny TRP (ang. Transient Receptor Potential).
Tworzą one kanały jonowe, czyli wydrążone struktury umożliwiające kontrolowany przepływ wybranych jonów przez błonę komórkową. Aktywacja takich kanałów powoduje depolaryzację, czyli wyrównanie stężeń jonów wewnątrz i na zewnątrz komórki nerwowej, co prowadzi do powstania impulsu nerwowego niosącego informację o wykrytym bodźcu. Znaczenie zagadnienia potwierdza Nagroda Nobla, jaką za badania nad receptorami temperatury i dotyku (w tym białkami TRPM8) otrzymali David Julius i Ardem Patapoutian w 2021 roku.
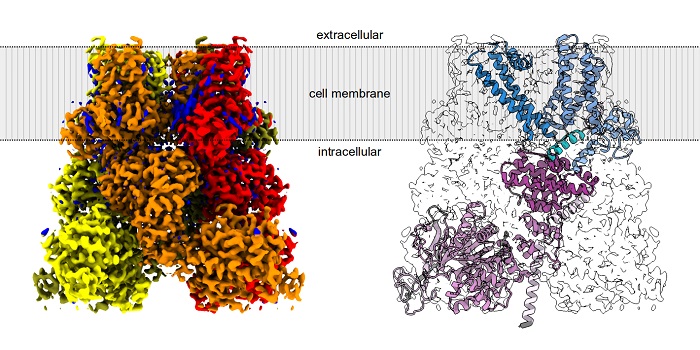
Naukowcy z IIMCB pod kierownictwem prof. Marcina Nowotnego, we współpracy z naukowcami z Włoch pod kierownictwem dr Carmine Talarico z Dompé Farmaceutici SpA, określili strukturę ludzkiego białka TRPM8 oraz stworzyli model jego wiązania z icyliną. Icylina (icilin) to syntetyczny związek, który u ludzi i zwierząt wywołuje wrażenie niezwykle silnego zimna. Wykazuje ona 200-krotnie silniejszą aktywację kanału jonowego TRPM8 niż mentol.
“Wiemy, że niektóre związki chemiczne pobudzają działanie naszych receptorów. Na przykład występujący w mięcie mentol aktywuje receptory zimna TRPM8, stąd odczucie zimna przy jedzeniu miętówek. Pobudzenie tych termoreceptorów jest jednak również powiązane z percepcją bólu, a wysycenie ich działania poprzez dłuższą ekspozycję na zimno lub mentol pozwalają zmniejszyć odczucie bólu. Dokładne zrozumienie działania termoreceptorów ma zatem ogromne znaczenie i docelowo umożliwia opracowanie terapii chorób powiązanych z tymi kanałami jonowymi. A do takich należą bóle neuropatyczne, zespół jelita drażliwego, dysfagia przedprzełykowa, przewlekły kaszel czy nadciśnienie tętnicze” – mówi dr Mariusz Czarnocki-Cieciura z Międzynarodowego Instytutu Biologii Molekularnej i Komórkowej w Warszawie.
Jak przekonują naukowcy, poznanie mechanizmu działania danego białka wymaga zbadania jego struktury, czyli tego, w jaki sposób łańcuch polipeptydowy układa się w przestrzeni. Kanały jonowe są jednak trudnymi obiektami badań dla biologów strukturalnych. Są zakotwiczone w błonie biologicznej, co utrudnia przeprowadzenie wielu eksperymentów. Ze względu na trudności z otrzymaniem ludzkiego białka TRPM8, pierwsze badania strukturalne tego kanału jonowego przeprowadzono stosunkowo niedawno, bo dopiero w 2018 na białkach ptasich i w 2022 roku na białkach mysich.
Naukowcy zajmujący się biologią strukturalną podkreślają ogromne znaczenie metody zwanej kriomikroskopią elektronową (cryo-EM). Przeżywa ona intensywny rozwój w ostatnich latach i stanowi swoisty przełom w obrazowaniu struktur molekularnych, których poznawanie było do niedawna niezwykle pracochłonne. Cryo-EM polega na wizualizacji badanych cząsteczek przy użyciu wysokorozdzielczego mikroskopu elektronowego w warunkach skrajnie niskich temperatur. Metoda ta umożliwiła poznanie struktury wielu białek błonowych, w tym licznych kanałów jonowych z rodziny TRP.
“Taką technologię wykorzystaliśmy w naszych badaniach – mówi dr Mariusz Czarnocki–Cieciura. – Dzięki wykorzystaniu mikroskopu elektronowego KRIOS zlokalizowanego w Narodowym Centrum Promieniowania Synchrotronowego SOLARIS w Krakowie udało nam się zobrazować pojedyncze cząsteczki tego kanału jonowego i na ich podstawie precyzyjnie określić jego strukturę”.
W badaniach wykorzystano również algorytm sztucznej inteligencji AlphaFold, opracowany przez Google DeepMind. “Metody modelowania przy użyciu AI zrewolucjonizowały biologię strukturalną. Umożliwiają one przewidywanie struktur białek przy użyciu komputera, jednak należy podkreślić, że nie zastępują one kosztownych i czasochłonnych badań eksperymentalnych. Stanowią jednak ich doskonałe uzupełnienie – pomagają formułować nowe hipotezy oraz wspomagają interpretację otrzymanych wyników, znacząco przyspieszając niektóre etapy badań” – informuje prof. Marcin Nowotny, kierownik Laboratorium Struktury Białka w IIMCB.(PAP)
Nauka w Polsce
lt/ bar/
Fundacja PAP zezwala na bezpłatny przedruk artykułów z Serwisu Nauka w Polsce pod warunkiem mailowego poinformowania nas raz w miesiącu o fakcie korzystania z serwisu oraz podania źródła artykułu. W portalach i serwisach internetowych prosimy o zamieszczenie podlinkowanego adresu: Źródło: naukawpolsce.pl, a w czasopismach adnotacji: Źródło: Serwis Nauka w Polsce - naukawpolsce.pl. Powyższe zezwolenie nie dotyczy: informacji z kategorii "Świat" oraz wszelkich fotografii i materiałów wideo.