
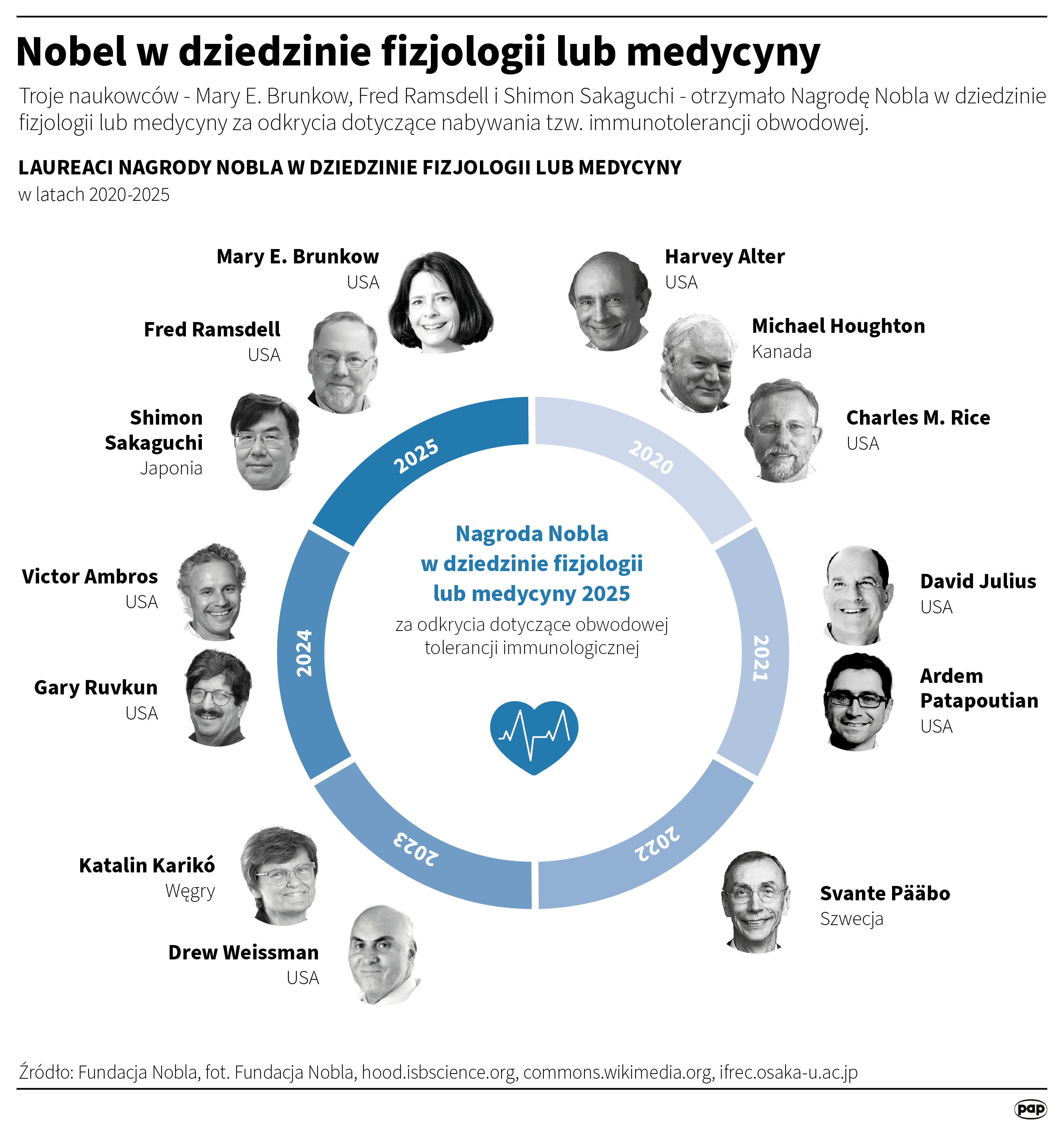
Tegoroczną Nagrodę Nobla w dziedzinie fizjologii i medycyny otrzymali Mary E. Brunkow i Fred Ramsdell z USA oraz Shimon Sakaguchi z Japonii. Dzięki ich odkryciu mechanizmów regulujących obwodowo odpowiedź immunologiczną można będzie skuteczniej leczyć choroby immunologiczne czy nowotwory.
Jak uzasadnił Komitet Noblowski, tegoroczni laureaci „zidentyfikowali komórki będące strażnikami układu immunologicznego - regulatorowe limfocyty T, dzięki czemu położyli podwaliny dla nowej dziedziny badań”.
Układ odpornościowy codziennie chroni nas przed tysiącami wirusów, bakterii i innych drobnoustrojów. Nie przetrwalibyśmy bez niego. Jak każda potężna siła, układ odpornościowy ludzkiego organizmu musi podlegać kontroli, inaczej mógłby przynieść więcej szkody niż pożytku. Dobrze widać to w przypadku chorób immunologicznych, w których kontrola zawodzi i układ odpornościowy atakuje własne narządy.
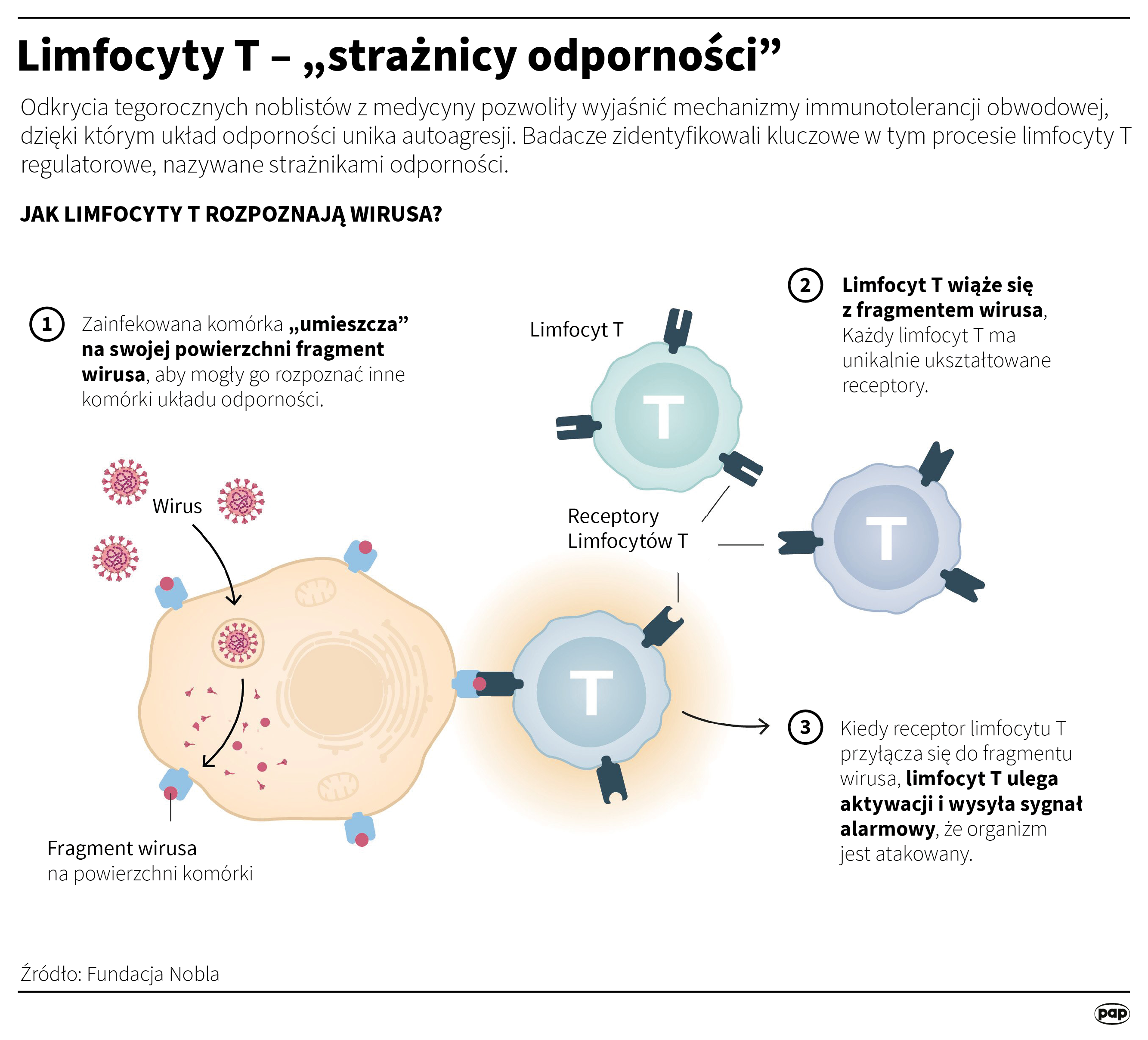
Aby układ odpornościowy był skuteczny, musi odróżniać patogeny od własnych komórek organizmu. Jednak wiele niebezpiecznych drobnoustrojów upodobniło się do komórek ludzkich. Skąd układ odpornościowy „wie”, co atakować, a co chronić?
Długo wydawało się, że odpowiedź jest znana: komórki układu odpornościowego dojrzewają w procesie zwanym centralną tolerancją immunologiczną. Jednak Mary Brunkow, Fred Ramsdell i Shimon Sakaguchi odkryli, że w grę wchodzi również obwodowa tolerancja immunologiczna. Zidentyfikowali oni komórki nadzorujące działanie układu odpornościowego limfocyty T regulatorowe – kładąc tym samym podwaliny pod nową dziedzinę badań. Ich odkrycia dają nadzieję na możliwość leczenia chorób autoimmunologicznych, zapewnienia skuteczniejszych metod leczenia raka i zapobiegania poważnym powikłaniom po przeszczepach komórek macierzystych.
Istnieją dwa główne rodzaje komórek odpornościowych, znanych jako limfocyty T. Pierwsze - limfocyty T pomocnicze - nieustannie patrolują organizm. Jeśli wykryją inwazyjne mikroorganizmy, alarmują inne komórki układu odpornościowego, które rozpoczynają atak. Z kolei limfocyty T zabójcy niszczą komórki zainfekowane wirusem lub innymi patogenami. Mogą również atakować komórki nowotworowe.
Wszystkie limfocyty T mają na powierzchni białka zwane receptorami limfocytów T. Za ich pomocą limfocyty T mogą „skanować” inne komórki, aby sprawdzić, czy organizm jest atakowany.
Ogromna liczba limfocytów T z różnymi receptorami sprawia, że zawsze znajdą się takie, które potrafią wykryć kształt atakującego drobnoustroju - nawet zupełnie nowe wirusy, jak ten, który zapoczątkował pandemię COVID-19 w 2019 roku. Jednak organizm nieuchronnie wytwarza również receptory limfocytów T, które mogą przyłączać się do części własnych tkanek. Dlatego takie „wywrotowe”, atakujące własne komórki, limfocyty muszą być wcześnie eliminowane.
W latach 80. XX wieku naukowcy zrozumieli, że gdy limfocyty T dojrzewają w położonej za mostkiem grasicy, przechodzą rodzaj testu, który eliminuje limfocyty T rozpoznające własne – endogenne – białka organizmu. Ten proces selekcji nazywa się tolerancją centralną.
Niektórzy badacze podejrzewali, że istnieją także komórki, które nazwali limfocytami T supresorowymi. Jednak z braku dostatecznych dowodów hipotezę tę zarzucono. Badania dotyczące regulatorowych limfocytów T kontynuował tylko Shimon Sakaguchi, który pracował w Instytucie Badawczym Centrum Onkologicznego Aichi w Nagoi w Japonii.
Sakaguchiego zainspirował wcześniejszy eksperyment przeprowadzony przez jego kolegów. Aby zrozumieć rolę grasicy w rozwoju limfocytów T, chirurgicznie usunęli oni ten narząd nowonarodzonym myszom. Postawili hipotezę, że myszy będą miały mniej limfocytów T i słabszy układ odpornościowy. Jeśli jednak operacja miała miejsce trzy dni po narodzinach myszy, układ odpornościowy wpadał w stan przeciążenia i chaosu, co prowadziło do rozwoju u myszy szeregu chorób autoimmunologicznych.
Aby lepiej zrozumieć to zjawisko, na początku lat 80. Shimon Sakaguchi wyizolował limfocyty T, które dojrzały u genetycznie identycznych myszy, i wstrzyknął je myszom bez grasicy. Uzyskany efekt sugerował, że limfocyty T mogą chronić myszy przed chorobami autoimmunologicznymi.
Limfocyty T pomocnicze można rozpoznać dzięki białku o nazwie CD4, podczas gdy limfocyty T zabójcy wyróżniają się białkiem CD8. W eksperymencie, w którym Sakaguchi chronił myszy przed chorobami autoimmunologicznymi, użył komórek z CD4 na powierzchni – limfocytów T pomocniczych. Zazwyczaj komórki te pobudzają układ odpornościowy i uruchamiają go, ale w eksperymencie Sakaguchiego układ odpornościowy został zahamowany. Jego wniosek był taki, że muszą istnieć różne formy limfocytów T, majace na powierzchni białko CD4. Aby przetestować swoją hipotezę, Sakaguchi musiał znaleźć sposób na rozróżnienie różnych typów limfocytów T. Zajęło mu to ponad dekadę, ale w 1995 roku w czasopiśmie The Journal of Immunology wykazał, że limfocyty T które uspokajają układ odpornościowy posiadają na swojej powierzchni nie tylko CD4, ale także białko CD25. Tę nową klasę nazwał limfocytami T regulatorowymi.
Jednak prace Sakaguchiego nie wszystkich przekonały. Dowodów dostarczyli Mary Brunkow i Fred Ramsdell.
Kluczową role odegrał zmutowany szczep myszy „scurfy”, który powstał podczas badań skutków promieniowania w latach 40. XX wieku. Niektóre samce urodziły się z łuszczącą się skórą, skrajnie powiększoną śledzioną i węzłami chłonnymi i żyły zaledwie kilka tygodni. Mutacja powodująca chorobę znajdowała się w chromosomie X. Połowa samców myszy jest chora, ale samice mogą żyć z tą mutacją, ponieważ mają dwa chromosomy X, z których jeden ma zdrowe DNA. W ten sposób samice przekazują mutację „scurfy” kolejnym pokoleniom.
W latach 90. XX wieku okazało się, że narządy „scurfy” są atakowane przez limfocyty T, które niszczą tkanki.
Mary Brunkow i Fred Ramsdell pracowali w firmie Celltech Chiroscience w Bothell w stanie Waszyngton w USA. Firma opracowywała leki na choroby autoimmunologiczne, a Brunkow i Ramsdell zdali sobie sprawę, że gdyby udało się zrozumieć molekularny mechanizm leżący u podstaw choroby myszy, mogliby uzyskać decydujące informacje na temat tego, jak powstają choroby autoimmunologiczne.
Dziś możliwe jest zmapowanie całego genomu myszy i znalezienie zmutowanego genu w ciągu kilku dni. W latach 90. XX wieku było to jak szukanie igły w stogu siana. Chromosom X u myszy składa się z około 170 milionów par nukleotydów. Znalezienie mutacji w tej masie DNA wymagało czasu, cierpliwości i kreatywnego wykorzystania narzędzi biologii molekularnej z tamtej epoki. Okazało się, że chodzi o wcześniej nieznany gen nazwany Foxp3, należący do genów regulujących działanie innych genów. Później ustalono, że rzadka choroba autoimmunologiczna, IPEX również powiązana z chromosomem X może być ludzkim wariantem mysiego scurfy.
W 2001 roku w czasopiśmie „Nature Genetics” Brunkow i Ramsdell ujawnili, że mutacje w genie FOXP3 powodują zarówno ludzką chorobę zwaną IPEX, jak i zły stan zdrowia u myszy z grupy scurfy. Kiedy naukowcy połączyli fakty w całość, zrozumieli, że gen FOXP3 może mieć znaczenie dla limfocytów T regulatorowych odkrytych przez Sakaguchiego.
Dwa lata później Shimon Sakaguchi – a wkrótce także inni badacze – mogli przekonująco udowodnić, że gen FOXP3 kontroluje rozwój limfocytów T regulatorowych. Komórki te zapobiegają omyłkowemu atakowaniu własnych tkanek organizmu przez inne limfocyty T, co jest ważne dla procesu zwanego obwodową tolerancją immunologiczną. Limfocyty T regulatorowe zapewniają również uspokojenie układu odpornościowego po wyeliminowaniu intruza, dzięki czemu nie działa on na najwyższych obrotach.
Dzięki tym badaniom pojawiły się potencjalne możliwości leczenia chorób immunologicznych czy ochrony przeszczepów (przez podwyższanie aktywności limfocytów T regulatorowych, na przykład za pomocą interleukiny-2 ) W niektórych przypadkach naukowcy modyfikują również limfocyty T, umieszczając na ich powierzchni przeciwciała, które działają jak etykiety adresowe. Pozwala to na wysłanie tych komórkowych strażników bezpieczeństwa, na przykład do przeszczepionej wątroby lub nerki, i ochronę tego narządu przed atakiem układu odpornościowego.
Możliwe wydaje się także wykorzystanie zdobytej wiedzy w onkologii. Mapowanie guzów nowotworowych pokazuje, że mogą one przyciągać dużą liczbę limfocytów T regulatorowych, które chronią je przed układem odpornościowym - dlatego mogłoby pomóc obniżanie aktywności limfocytów regulatorowych.
Mary E. Brunkow (64 lata) obroniła doktorat na Princeton University (Princeton, USA). Obecnie prowadzi badania w Institute for Systems Biology w Seattle.
Fred Ramsdell (65 lat) został doktorem na University of California (Los Angeles, USA). Obecnie pracuje w firmie Sonoma Biotherapeutics w San Francisco, która opracowuje terapie komórkowe dla pacjentów z chorobami autoimmunologicznymi i zapalnymi.
Japończyk Shimon Sakaguchi (74 lata) uzyskał tytuł doktora na Uniwersytecie w Kioto w Japonii. Obecnie pracuje na Uniwersytecie w Osace. Jego odkrycia znalazły zastosowanie w immunoterapii nowotworów, a także w badaniach nad nowymi terapiami dla pacjentów z chorobami alergicznymi i autoimmunologicznymi.
Nagrodą, w wysokości 11 mln koron szwedzkich, podzielą się po równo.
Paweł Wernicki (PAP)
pmw/ zan/
Fundacja PAP zezwala na bezpłatny przedruk artykułów z Serwisu Nauka w Polsce pod warunkiem mailowego poinformowania nas raz w miesiącu o fakcie korzystania z serwisu oraz podania źródła artykułu. W portalach i serwisach internetowych prosimy o zamieszczenie podlinkowanego adresu: Źródło: naukawpolsce.pl, a w czasopismach adnotacji: Źródło: Serwis Nauka w Polsce - naukawpolsce.pl. Powyższe zezwolenie nie dotyczy: informacji z kategorii "Świat" oraz wszelkich fotografii i materiałów wideo.













