Podejrzano w akcji bardzo ważny enzym - elongator. To kompleks istotny dla właściwego fałdowania się wszystkich białek obecnych w komórkach organizmów tak różnych jak bakterie, zwierzęta, rośliny czy grzyby. W badaniach brali udział Polacy.
Białka to podstawowe zestawy klocków, z których zbudowana jest komórka i które napędzają ją do życia. Każda komórka musi więc sobie stale takie białka produkować. Ma to miejsce w rybosomach. To tam mRNA przynosi wyciągnięty z DNA przepis na białka, a tRNA dostarcza odpowiednie aminokwasy - składniki białek.
Cała ta praca musi jednak przebiegać w odpowiednim tempie. Białka to przecież struktury o skomplikowanej trójwymiarowej budowie. Jeśli proces łączenia aminokwasów w białka przebiega zbyt szybko albo zbyt wolno, białka źle się sfałdują. A źle sfałdowane białko nie działa już tak, jak powinno.
Wiadomo już było, że na tempo produkcji każdego białka wpływ ma pewien kompleks białkowy - tzw. elongator. Odpowiada on za wprowadzenie modyfikacji chemicznych w tRNA. Wcześniej wykazano, że jeśli elongator działa nieprawidłowo, zawodzi dynamika rybosomów - tworzone są zdegenerowane lub źle sfałdowane białka oraz tzw. białkowe agregaty wewnątrzkomórkowe.
Wystąpienie mutacji w którejkolwiek z sześciu podjednostek elongatora powiązane jest u ludzi z poważnymi chorobami. To m.in. dysautonomia rodzinna (to choroba autonomicznego układu nerwowego), otyłość, astma oskrzelowa, niepełnosprawność intelektualna, przerost komór serca, padaczka Rolanda czy nowotwory.
Elongator to enzym tak ważny, że obecny jest w komórkach zarówno bakterii, roślin, grzybów czy zwierząt. Nie dziwne więc, że naukowcy postanowili zrozumieć, jak taki kompleks działa i uchwycić go w akcji. To się udało! Wyniki badań ukazały się w "Science Advances".
"Nasza praca mówi o tym, w jaki sposób tRNA jest wiązane w miejscu aktywnym kompleksu" - mówi dr Sebastian Glatt, lider grupy badawczej Maxa Plancka w Małopolskim Centrum Biotechnologii Uniwersytetu Jagiellońskiego i jeden z autorów korespondencyjnych badania.
Naukowcy mają też nadzieję, że w przyszłości będzie możliwe projektowanie leków przeciw chorobom związanym z elongatorem.
"Po dziesięciu latach badań nad tą dużą maszyną komórkową, w końcu zaczynamy mieć bardziej klarowny obraz skomplikowanych interakcji pomiędzy różnymi podjednostkami elongatora a związanym substratem tRNA, które umożliwiają zajście reakcji modyfikacji" - mówią uczestnicy badań dr Christoph W. Müller (EMBL w Heidelbergu) i dr Jan Kosinski (EMBL w Hamburgu).
W badaniach zastosowano tzw. metodę kriomikroskopii elektronowej - cryo-EM (opracowanie tej metody wyróżniono Nagrodą Nobla w dziedzinie chemii w 2017 roku). "W biologii strukturalnej ciężko zaobserwować dynamiczne procesy. Możliwe jest jednak coś w stylu poklatkowego robienia zdjęć. Chcemy uchwycić struktury przedstawiające różne etapy modyfikacji tRNA. Na ich podstawie będziemy mogli wyciągnąć wnioski na temat molekularnego mechanizmu reakcji modyfikacji" - opowiada w rozmowie z PAP dr Marcin Jaciuk z MCB.
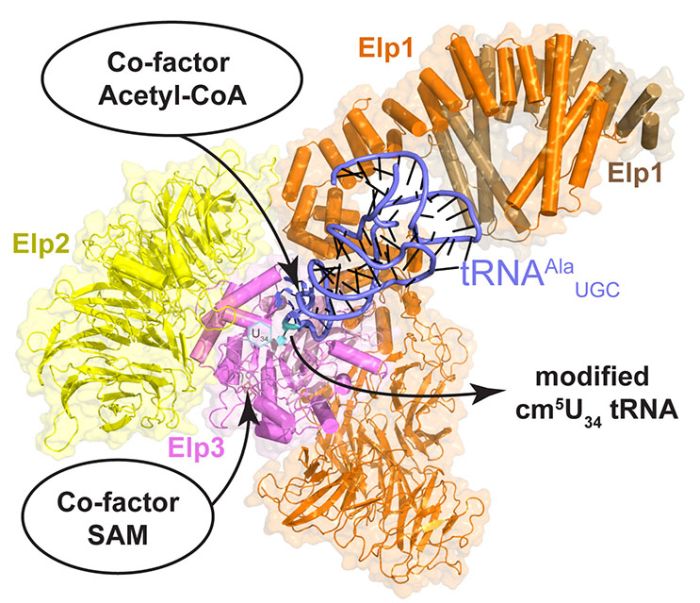
Struktura elongatora - enzymu istotnego dla fałdowania się białek. Źródło: MCB UJ
Przedstawiciele MCB UJ informują, że najwyższej klasy cryo-EM wkrótce dostępne będzie również w Polsce. W Narodowym Centrum Promieniowania Synchrotronowego SOLARIS UJ zainstalowano już nowoczesny mikroskop wyposażony w najnowsze, bezpośrednie detektory elektronów. Mikroskop jest obecnie testowany, a następnie zostanie oddany do użytku dla naukowców. Szczegóły dotyczące składania wniosków o czas pomiarowy na mikroskopie można znaleźć na stronie Solaris.
Badania w Krakowie finansowane były z grantu OPUS z Narodowego Centrum Nauki oraz z programów Homing i Team Tech Core Facility z Fundacji na rzecz Nauki Polskiej (FNP) przy wsparciu Structural Biology Core Facility w MCB.
PAP - Nauka w Polsce, Ludwika Tomala
lt/ ekr/
Fundacja PAP zezwala na bezpłatny przedruk artykułów z Serwisu Nauka w Polsce pod warunkiem mailowego poinformowania nas raz w miesiącu o fakcie korzystania z serwisu oraz podania źródła artykułu. W portalach i serwisach internetowych prosimy o zamieszczenie podlinkowanego adresu: Źródło: naukawpolsce.pl, a w czasopismach adnotacji: Źródło: Serwis Nauka w Polsce - naukawpolsce.pl. Powyższe zezwolenie nie dotyczy: informacji z kategorii "Świat" oraz wszelkich fotografii i materiałów wideo.