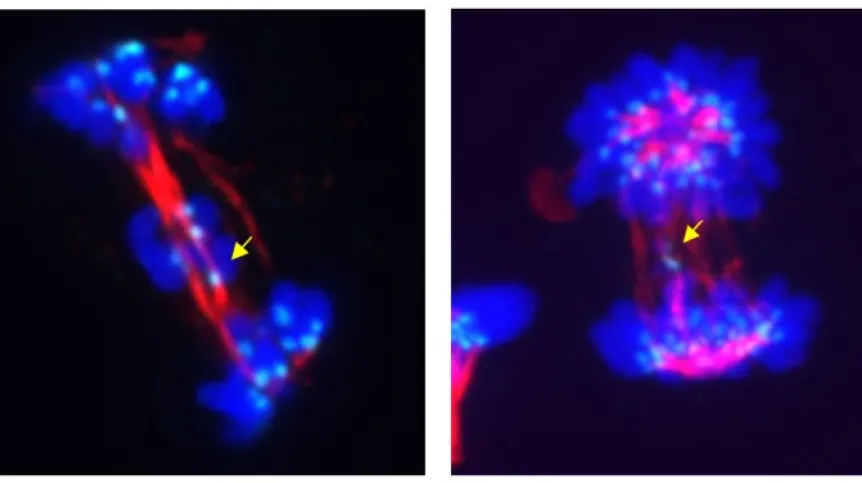
Mitoza - prowadzi ona do powstania z jednej komórki dwóch identycznych komórek potomnych - to podstawa życia, wzrostu i rozmnażania. Zdawało się, że to już dobrze zrozumiany proces. Tymczasem do wiedzy o nim dołożono kolejną cegiełkę.
Studenci biologii i medycyny z pewnością "ucieszą się" z informacji, że proces mitozy poznano jeszcze bardziej dokładnie i akademickie podręczniki do biologii wymagać będą aktualizacji.
Zespół z kilku amerykańskich ośrodków (Dana-Farber Cancer Institute, Harvard Medical School, Fred Hutchinson Cancer Center oraz Purdue University) wykazał, że pewien niedoceniany enzym, cyklinozależna kinaza 5 (CDK5), odgrywa kluczową rolę w podziale komórki. W pracach grupy brał udział Polak, dr Bartłomiej Tomasik z Gdańskiego Uniwersytetu Medycznego. Artykuł - owoc wieloletniej pracy tego zespołu - został niedawno opublikowany w czasopiśmie “Nature”.
Kinaza inna niż wszystkie
CDK5 wydawała się szczególną ekscentryczką w grupie kinaz zależnych od cyklin, bo od cyklin wydawała się być… całkiem niezależna. Wchodziła w związki z innymi białkami, p35 oraz p39, a nazwę nadano jej "na wyrost" - głównie dlatego, że strukturą przypominała inne kinazy z grupy CDK. Jak dotąd opisy funkcji CDK5 dotyczyły przede wszystkim jej aktywności w neuronach, ale nowe wyniki pokazują nową, nieznaną dotąd twarz tego białka.
"Nasze wyniki sugerują, że mniej typowe CDK – takie jak CDK5 – mogą również odgrywać rolę w regulacji cyklu komórkowego. To odkrycie zmienia istniejący dogmat biologii molekularnej" - komentuje w rozmowie z PAP dr Tomasik.
Opisane wyniki wskazują, że CDK5 słusznie otrzymała swą nazwę, bo jednak jest zależna od pewnej cykliny. Chodzi o cyklinę B1 - tę samą cyklinę mitotyczną, która współdziała z CDK1, kluczowym i dobrze opisanym regulatorem mitozy.
"CDK5 została więc przez nas wprowadzona do rodziny CDK jako jej pełnoprawny członek" - podsumowuje dr Tomasik. I dodaje, że CDK5 okazała się kanoniczną kinazą regulującą cykl komórkowy, niezbędną do utrzymania stabilności genomu.
Gdy mitoza idzie nie tak, czyli jak "popsuć" podział komórkowy
Naukowcy wzięli CDK5 na warsztat, ponieważ jej nadekspresję obserwowano w komórkach nowotworowych. Wydawało się, że białko to pełni funkcje przede wszystkim w układzie nerwowym, w komórkach, które nie ulegają już podziałom. Z tego powodu przez lata wykluczano, że CDK5 ma istotny związek z podziałami komórek. Czyżby jednak zapomniano, że jedno białko może pełnić wiele funkcji?
Autorzy publikacji zastąpili natywną CDK5 wariantem, który specyficznie wiąże się z substancjami hamującymi lub degradującymi CDK5 przed wejściem komórek w mitozę. Następnie pokazali, że komórki, w których wyłączy się CDK5 na czas mitozy (tak, takie “cuda” są już w laboratoriach możliwe!), wykazują zaburzenia w pracy wrzeciona kariokinetycznego.
Wrzeciono ma za zadanie symetrycznie rozdzielić pary powielonych chromosomów między komórki potomne. Blokowanie CDK5 sprawiło m.in., że w niektórych komórkach potomnych było zbyt dużo chromosomów, a w innych – za mało. A to droga wiodąca komórkę w stronę kłopotów.
Potencjalne zastosowanie w terapii przeciwnowotworowej
Z punktu widzenia organizmu taki chaos w zdrowych komórkach to katastrofa, która może prowadzić zarówno do śmierci komórki, jak i rozwoju nowotworu. Tym bardziej, że białko CDK5 ulega nadmiernej ekspresji w wielu nowotworach, a jego nadmiar to zwykle zły znak dla pacjenta. Jednak skoro CDK5 jest tak istotne dla nowotworów i napędzania ich podziałów, to może być także kluczem do ich unicestwienia!
"Skoro rozwój wielu nowotworów może być zależny od poziomu CDK5, to stosowanie inhibitorów CDK5 wydaje się być kuszącą formą terapii" – komentuje dr Tomasik.
Jego zdaniem warto prowadzić prace nad inhibitorami CDK5 i testować jak spiszą się w walce z nowotworami. Szczególnie, że hamowanie aktywności innych cyklinozależnych kinaz – CDK4/6 – jest już z powodzeniem stosowane w leczeniu raka piersi. "CDK5 do tej pory nie była brana pod uwagę, bo nie znano jej roli w namnażaniu komórek. Teraz wiadomo już, że ta rola jest kluczowa" – mówi badacz.
"Jednak droga od badań podstawowych do skutecznej klinicznie terapii jest wciąż długa i wyboista, jak każda podróż naukowa – dlatego dalsze badania nad CDK5 są niezbędne!" - ocenia dr Tomasik.
Dr Tomasik jest lekarzem zajmującym się radioterapią onkologiczną, a jednocześnie współkoordynatorem zespołu badawczego zajmującego się biologicznymi i fizycznymi aspektami promieniowania jonizującego oraz ich przełożeniem na praktykę kliniczną . Grupa aktywnie poszukuje partnerów do dalszych działań naukowych.
Nauka w Polsce, Ludwika Tomala
lt/ agt/
Fundacja PAP zezwala na bezpłatny przedruk artykułów z Serwisu Nauka w Polsce pod warunkiem mailowego poinformowania nas raz w miesiącu o fakcie korzystania z serwisu oraz podania źródła artykułu. W portalach i serwisach internetowych prosimy o zamieszczenie podlinkowanego adresu: Źródło: naukawpolsce.pl, a w czasopismach adnotacji: Źródło: Serwis Nauka w Polsce - naukawpolsce.pl. Powyższe zezwolenie nie dotyczy: informacji z kategorii "Świat" oraz wszelkich fotografii i materiałów wideo.













